
Fibroadenoame mamare (mama)– 42 ani/1,62 m/ 76 kg

Displaziile1mamare pot avea multiple forme de manifestare: chiste lichidiene, ectazii ductale, mastodinie, fibrochistoză, mastoză fibrochistică, papiloame intraductale, fibroadenoame etc. Acum și aici ne vom ocupa de fibroadenoame, cea mai comună displazie mamară, dar căreia i se pot stabili unele cauze și caracteristici comune cu orice alte forme ale displaziilor mamare.
Pentru „detectarea” nodulilor mamari și pentru diagnosticarea caracterului lor benign sau malign, sunt o serie de metode, care „merg” de la simpla autopalpare și diverse metode imagistice, până la biopsia diagnostică și examenul histopatologic. Aceste lucruri sunt în general știute, iar femeile cu astfel de probleme vor apela întotdeauna la medicul specialist.
Sunt fibroadenoame (noduli, fibronoduli, fibrochiste) mamare care uneori se resorb – de la sine sau cu unele tratamente -, altele pot rămâne benigne, iar altele pot canceriza. Toate aceste evoluții, începând cu modificările mediului intern al organismului necesar apariției fibroadenoamelor, noi le privim, în premieră în literatura medicală, prin prisma disproteinemiei, pe care o corelăm evoluțiilor hormonale.
Literatura medicală estimează că numai circa 3% din cancerele mamare sunt determinate genetic, în timp ce 97% - cu variații procentuale de la 95% la 98% - se datorează malignizării fibroadenoamelor mamare. De asemenea, cancerele mamare sunt cauza celor mai numeroase decese din cauza malignizărilor în rândul femeilor. Debutul cancerelor prin malignizarea fibroadenoamelor mamare care, cu rare excepții rămân mulți ani benigne, are loc în marea majoritate a cazurilor, după instalarea menopauzei. Deci atunci cînd nivelul estradiolului scade!
Cauzele apariției fibronodulilor mamari sunt mult discutate în literatura medicală de specialitate, incriminată fiind mai ales hiperestrogenemia (teorie determinată de faptul că majoritatea nodulilor cancerizați prezintă mai mulți receptori pentru estrogeni – circa 70% -, numai circa 30% prezentând mai mulți receptori pentru progesteron).
Noi nu susținem această teorie. Nu numai datorită faptului că majoritatea fibroadenoamelor cancerizează după intrarea femeii în menopauză, deci atunci când nivelul estradiolului scade fiziologic. Un număr însemnat de studii evidențiază faptul că administrarea estrogenilor pentru tratarea osteopeniei sau osteoporozei, ca unică terapie hormonală în perioada menopauzei, par a favoriza debutul cancerelor mamare. De asemenea, terapia cu estrogeni a cancerelor mamare debutate, sau pentru prevenirea recidivei ori metastazării post operatorii, par a avea efecte inverse celor așteptate. Sunt și autori care susțin unele beneficii ale terapiei cu estrogeni în cancerele mamare, dar numărul cazurilor raportate privind eficiența acestei monohormonoterapii sunt prea puține pentru a ne convinge. De fapt, noi ne pronunțăm împotriva monoterapiei hormonale din motive întemeiate, oricare ar fi hormonul administrat.
Nu susținem această teorie nici datorită faptului că putem prezenta cazuri clinice de fete în vârstă de 16-20 de ani care, traversând un sindrom de androgenizare sever, în absența menstrelor – în unele cazuri de peste un an –, fac fibroadenoame mamare. Hipoestrogenemia lor este evidentă nu numai clinic, ci și paraclinic: estradiolul (ESTR) prezintă valori scăzute, în timp ce progesteronul (PRG) și prolactina (PRL) au valori crescute. Acestea fac polichiste ovariene, sânii se tensionează în zona timpului în care ar trebui să debuteze menstra, în unele cazuri apare tenul seboreic și acneea, părul se îngrașă mai repede decât obișnuit (în cazuri rare este foarte uscat), au circulația periferică deficitară, sânii sunt subdimensionați vârstei, pot face hirsutism, devin irascibile, uneori introvertite, frustrate etc. Atunci când menstrele continuă să întârzie ori/și apar polichistele ovariene, li se recomandă terapii cu contraceptive estroprogestative sau cu progestative. În multe cazuri, chiar dacă menstrele se restabilesc, chiar dacă polichistele dispar, aceste „succese” se prăbușesc atunci când se întrerupe terapia. În majoritatea cazurilor, oricare ar fi rezultatele terapiei expuse mai sus, aceste tinere evoluează către endometrioză – afecțiune în care organismul face efortul de a produce un plus de estrogeni care ar trebui să restabilească raportul normal cantitativ față de hormonii PRG și PRL, care cresc spre- sau peste v.n2.
Atâta timp cât fibromatoza mamară – cu apariția de fibroadenoame - nu este abordată prin prisma disproteinemiei caracteristice oricărei alte fibrozări autoimune, dar cu conotațiile ei hormonale, tot atâta timp cauzele afecțiunii vor rămâne insuficient înțelese. Iar ca să fie înțelese, este necesar ca PT, EPS și Ca2+ să devină analize medicale de rutină. Numai atunci și numai astfel se poate aborda o temă medicală absentă în literatura medicală și tot atât de absentă în practica clinică: profilaxia riscului de a face fibroadenoame mamare. Iar această profilaxie, extrapolând, este și cea mai eficace și mai normală metodă profilactică a cancerelor mamare (specialiștii afirmând că fibroadenoamele sunt cauza a 97% dintre acestea3).
Am inclus cazul clinic ilustrat cu analizele de mai sus în studiul nostru, pentru că am considerat că este unul dintre cazurile destul de comune de posibilă evoluție înspre apariția fibroadenoamelor. O precizare însă, este necesară: nu este deloc obligatoriu ca apariția fibroadenoamelor mamare să fie preccedată de apariția fibromatozei uterine. În astfel de cazuri însă, fibroza uterină este de regulă însoțită de fibrozarea sânilor. O condiție esențială a apariției fibroamelor este hiperprolactinemia. Dar nu toate femeile care prezintă hiperprolactinemie fac fibroadenoame mamare. Nu am întocmit încă o statistică, dar numărul femeilor care fac fibroadenoame mamare fără un fibrom în APP, este mai mare decât cel al femeilor care au făcut un fibrom. Cauza acestei frecvențe crescute este aceea că, pe lângă un număr de fete născute cu predispoziția congenitală înspre androgenizare, crește numărul celor androgenizate prin administrarea estroprogestativelor (alături de orice alte cauze ale evoluțiilor hormonale androgenizante). În toate cazurile însă, hiperprolactinemia precede apariția fibroadenoamelor mamare. ALB scade la- sau sub minim v.n. ca și Ca2+, în timp de imunoglobulina γ crește înspre sau peste v.n., fapt care indică un anume grad de autoimunitate.
În cazul de față pacienta, curând după ce a născut o fetiță, a fost diagnosticată cu fibrom uterin. În cazul acestei afecțiuni, caracterizată hormonal prin creșterea ESTR și valori reduse ale ale PRG și PRL, cresc valorile PT prin creșterea nivelelor globulinelor fibroproteine, în timp ce ALB scade procentual în cadrul PS. În paralel, crește și cantitatea de fibroproteine în sâni: buletinele ecografice notează o structură intens fibroglandulară a acestora. Autoimunitatea este demostrată și paraclinc, prin creșterea excesivă a globulinei γ. În condițiile unei calcemii totale normale (CaT=9,46 mg/dL), scăderea procentuală a ALB înspre minima v.n., corespunde ionizării unei cantități reduse a calciului (din CaT se ionizează numai 0,2mg peste minima v.n. a Ca2+), fapt care determină apariția litiazei renale (prin oxalatul de calciu existent în urină, care nu înseamnă altceva decât o cale de a elimina surplusul de calciu4 care nu se ionizează).
Pacienta nu a luat nici o măsură pentru uterul fibromatos. În schimb, pentru a nu avea nici o grijă, timp de aproape opt ani a luat contraceptive estroprogestative. Urmarea: schimbarea status-ului hormonal predominant estrogenic, cu hipoestrogenemia și androgenizarea hormonală, care este însoțită de creșterea PRG și PRL. Consecința: apariția fibroadenoamelor mamare.
Aici credem că este necesar să lămurim cum anume apar fibroadenoamele mamare. Așa cum am spus, scăderea valorii procentuale a ALB în cadrul EPS este însoțită de creșterea cantitativă a globulinelor fibroproteine și a imunoglobulinei γ. Sânii sunt un alt loc de „descărcare” din sînge a excesului de fibroproteine. Ca în orice alte cazuri de fibrozare mamară, ecografiile anterioare formării fibroadenoamelor consemnează structura fibroglandulară crescută a sânilor. Atunci când sânii au o astfel de structură, dacă PRL înregistrează creșteri care induc tensionarea sânilor cu un număr de zile antemenstrual, lobulii și canalele galactofore se umplu cu un lichid care nu este lapte - ca în lactația normală post partum -, dar conține o anumită cantitate de proteine. Odată cu debutul menstrei, sânii încep să se detensioneze, semn al reducerii treptate a lichidului acumulat antemenstrual în lobuli și ducte, simultan scăderii nivelului PRL. În unele cazuri însă, cantități din acest lichid rămân în lobuli, iar organismul, care are propriile sale mijloace de autoprotecție, „țese” în jurul lobulului o capsulă cu structură fibroasă5 (nodul, fibrochist, fibroadenom).
Ca manifestări ale disproteinemiei, „terenul” apariției fibroadenoamelor este pregătit de dezechilibrul PT, a căror cantitate crește prin creșterea sintezei peste nivelul optim al fibroproteinelor și a altor proteine de fază acută pozitive. Dezechilibrul PT este indicat mai ales de dezechilibrul din structura PS în cadrul EPS: nivelul procentual al ALB scade înspre nivelul minim al v.n. sau chiar și sub acesta, în timp de nivelul procentual al GL crește. Dintre acestea, creșterea globulinei γ indică o conotație autoimună a fibrozării. În măsura în care nivelul inflamației autoimune crește (corespunzător creșterii imunoglobulinei γ), crește și sinteza cortizolului de către glandele supracorticale. În valori normale, cortizolul are efecte antiinflamatorii și imunosupresoare. Dacă nivelul său seric crește înspre- sau peste v.n., dintr-un aliat al homeostaziei, devine un veritabil agresor. Nivelul cortizolului influențează metabolismul lipidic, glucidic și proteic. Este implicat atât în producerea disproteinemiilor la nivele PT și PS, ca și în androgenizarea hormonală prin influențarea creșterii PRG și PRL. Stimulează creșterea lipidemiei și poate conduce la obezitate (vezi analizele de mai sus).
Știm că hipercortizolemia, prin contribuția directă la creșterea PRG și PRL are efecte androgenizante6. Ar fi interesant de știut dacă - și în ce măsură -, creșterea cortizolului ar putea fi implicat în interferarea funcțiilor aromatazei la nivelul ovarelor (de transformare a PRG în ESTR). În practica clinică apiterapeutică, noi obținem diminuarea PRL în androgenizările hormonale și datorită faptului că restabilim echilibrul PT prin reechilibrarea PS, ca și prin:
- stimularea organismului de a sintetiza o cantitate crescută de dopamină, care este un frenator al creșterii PRL (precursorii acestui neurotransmițător existând în strucura apiterapcelor);
- reechilibrarea funcțiilor enzimei aromatază la nivelul ovarelor, reducând astfel nivelul PRG și crescând nivelul ESTR (enzima aromatază, ca și precursorii acesteia, se află în structura apiterapicelor).
Creșterea cortizolului seric înspre- ori peste v.n. – cu efectele sale androgenizante -, este unul dintre argumentele noastre în susținerea teoriei privind androgenizarea ca fiind și cauză a endometriozelor (compară nivelul cortizolului în acest caz, cu nivelul său în Cazul 3, Endometrioză).
Supravegherea ecografică a fibroadenoamelor, iar la recomandarea medicului prin mamografii ori alte mijloace de investigație, este foarte necesară.
EPS, evoluția Ca2+ și ecografia Doppler power sunt investigații care, efectuate periodic, pot estima corect o posibilă evoluție alarmantă a fibroadenoamelor.
Cazul acesta - al mamei cu fibroadenoame mamare - oferă rarul avantaj de a putea fi alăturat comparativ celui al fiicei sale, care a făcul polichiste ovariene și fibrochiste mamare, fiind și un argument privind androgenizarea hormonală a fiicelor mamelor cu manifestări autoimune.
Fiica (17 ani/1,62 m/ 47 kg) – fibroadenoame mamare și polichiste ovariene

EPS și celelalte analize ale fiicei, comparate cu cele de mai sus ale mamei, sunt semnificativ asemănătoare, atât la nivelul PT (cu valori în creștere) și al EPS (cu ALB înspre nivelul minim și cu GL crescute, mai ales la nivelul globulinei γ), cât și la nivelul status-ului hormonal androgenizant: ESTR cu valori scăzute, iar PRG și PRL cu valori apropiate de maximul v.n.
Menarha a avut-o la aproape 15 ani, fiind urmată de menstre neregulate, dureroase, hipomenoreice, cu sâni mici, dar care se tensionau dureros antemenstrual. Abia trecută de vârsta de 16 ani, cu menstra absentă de 11 luni, prezintă polichiste ovariene bilateral, iar ecografic sânii au o structură cu „predominanța țesutului fibroglandular” și cu „leziuni chistice bilaterale”. Cum este și de așteptat, fibroadenoamele sunt benigne ( scor BIRAD-S 2). Corespunzător nivelului scăzut al ALB, prezintă hipocalcemie ionică (Ca2+ se află sub minima v.n.), deși CaT are v.n. . Scăderea Ca2+ sub v.n., deși CaT are v.n., este consecința scăderii procentuale a ALB și, între altele, este și cauza crizelor de spasmofilie pe care le face. Este încă un argument pentru a introduce, între analizele de laborator de rutină a EPS și a Ca2+. A aprecia calcemia numai prin determinarea CaT, este precondiția unor erori diagnostice.
Rezumând:
- ALB scăzutăcorespunde creșterii globulinei β, imunoglobulinei γ și sintezei crescute a
fibroproteinelor care, în acest caz, fibrozează sânii;
- scăderea procentuală a ALBîn EPS, corespunde ionizării unei cantități reduse de Ca;
- scolioza lombarăa fiicei corespunde hipocalcemiei materno-fetale;
-hipocalcemiacare o însoțește de-a lungul celor 17 ani, este rezultatul unei moșteniri congenitale, permanentizată prin permanentizarea hipoalbuminemiei congenitale și, într-o anumită măsură, prin efectele hipoestrogenemiei;
- creșterea cortizolului, care are proprietăți antiinflamatorii, este determinată de creșterea imunoglobulinei γ la- sau peste v.n., creștere predictivă pentru inflamațiile autoimune7;
- cortizolul sericnu este „măsurat” cantitativ, dar credem că ne aflăm în fața unui caz de autohipercortizolemie cu predispoziție congenitală, care corespunde: androgenizării hormonale, hipoglicemiei8(glicemia este la minima v.n.), creșterii lipidemiei (la valori aproape identice mamei) și autoimunității cronicizate - pneumonia interstițială idiopatică9, alergia și sinuzita au cauze autoimune -, care sunt indicate de creșterea anticorpilor (imunoglobulina γ are constant valori crescute la limita superioară a v.n.).
Androgenizarea hormonală a fetei este urmarea unei predispoziții congenitale dobândită materno-fetal, deci în viața intrauterină. Afirmativ, fata nu a luat estroprogestative și, în general, nu a urmat nici un fel de tratament hormonal10.
Și mai puțin obișnuit este faptul că am putut urmări, prin prisma AHC, dar și a documentelor medicale aflate la dosarul cazului, disproteinemia cu caracter autoimun al pacientei, încă de la vârsta de șase ani.
EPS – la vârsta de șase ani:
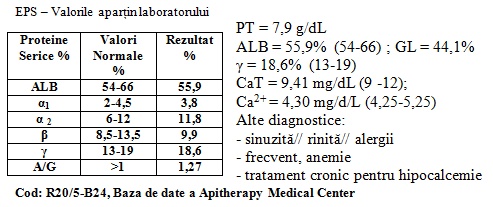
Electroforeza de mai sus – caz foarte rar - este făcută la vârsta de 6 ani. Valorile determinate ale PT, EPS, CaT și Ca2+ sunt foarte apropiate de cele de la vîrsta de 17 ani. Ambele seturi de analize ale fiicei (chiar și cele de la vârsta de 6 ani), sunt asemănătoare cu cele ale mamei, care face fibroadenoame mamare. Ambele, mamă și fiică, prezintă afecțiuni cu caracter autoimun, în care includem și fibroza mamară. Fibromul uterin al mamei are cauze endogene, fiind o manifestare a disproteinemiei (în cadrul căreia hipoalbuminemia care se corelează cu hipocalcemia ionică). Nu știm când a apărut fibromul uterin al mamei, dar exista la vîrsta de 3 ani a fetiței. Cum se explică influența materno-fetală a acestui tip de disproteinemie maternă (fibromul ), diagnosticat odată cu astmul bronșic, care este tot o boală autoimună - la 3 ani după nașterea sa?
Nu știm valorile EPS și Ca2+ ale mamei, nici înainte de dobândirea sarcinii, nici în sarcină – când avea 25 de ani, nici după naștere. Aceste analize au fost făcute abia la vîrsta de 42 de ani, la recomandarea noastră. În sarcină, ALB și Ca au continuat să scadă, fiind „împărțite” cu fiica, dar nici aceasta nu a putut „primi”, prin sângele placentar, cantități suficiente. Scăderea ALB în sarcină, a corespuns creșterii imunoglobulinei γ și scăderii Ca, fapt care a putut determina creșterea cortizolului – cu acțiuni antiinflamatorii antiautoimune –, dar și cu acțiuni androgenizante. Fiica se naște cu predispozițe androgenizantă, cu o posibilă predispoziție transmisă de a nu putea produce sau de a nu putea activa corect enzima aromatază.
__________________________________
1.Displazii – anomalii care apar în strutura anatomică a unui țesut sau a unui organ.
2.Atunci când vorbim despre dezordinea hormonală care precede și însoțește fibroadenoamele mamare, nu avem în vedere neaparat anumite valori cantitative ale ESTR, PRG și PRL. Se pare că un status hormonal normal, în care fiecare tip de hormoni „își face corect datoria”, nu neaparat cantitățile unui sau altuia dintre hormoni „decid” normalitatea funcțională. Desigur, valorile cantitative determinate au importanța lor. Dar mai curând este vorba de menținerea unor anumite proporții între valorile diferiților hormoni, ca și timpul când aceștia își îndeplinesc funcțiile, cu interferarea sau susținerea funcțiilor altor hormoni. Înțelegerea corectă a cauzelor disfuncțiilor hormonale, necesită raportarea status-ului hormonal la valorile EPS.
3.Atunci când am abordat tema lucrării de față, privind stabilirea de alte limite ale v.n. ale PT și EPS -, am intenționat ca, exemplificând cu un număr de boli, doar să atragem atenția necesității de a se adopta alte limite ale v.n. pentru PT și EPS. Atunci cînd o valoare determinată de laborator se înscrie în limitele v.n., boala ar trebui să fie exclusă. Dacă analizele indică normalitatea înscrierii valorilor determinate în v.n., dar bolile sunt frecvente, atunci acestea seamănă oarecum cu o perucă (realitatea este ceea ce se ascunde !). Cu atât mai mult avem nevoie de v.n. reale ale analizelor de laborator, cu cât profilaxia fibroadenoamelor mamare, conform teoriei noastre, înseamnă și certitudinea profiolaxiei debutului cancerelor mamare. Inspre această teorie ne-au orientat albinele – care ne-au oferit substanțele necesare -, abordarea holistică a afecțiunii, integrată în antecedentele patologice personale (APP) și în posibilele antecedentele heredocolaterale (AHC). Și, alături de acestea, ne-a ajutat practica recomandării unor analize complexe, ca și cea a studierii comparative a cazuisticii clinice. La „vorba lungă” și la abaterea de la proiectul inițial însă, ne-a îndemnat ideea că, în măsura în care ceea ce spunem are puterea de a convinge cu un ceas mai devreme, tot cu un ceas mai devreme vom putea preveni nu numai debutul formării fibroadenoamelor, ci și „răul cel mare” de mai târziu – cancerizarea mamară (vezi cazurile clinice următoare).
4.În cazul de față nu este vorba de un surplus real al calciului – nici la nivelul CaT circulant sanguin, nici la nivelul Ca2+. Vorbim de ionizarea unei cantități prea reduse din CaT, deși nevoile organismului de valori mai crescute ale Ca2+ există – vezi analizele. Întotdeauna, cu excepția cancerelor, curba reducerii procentuale a ALB în cadrul EPS este urmată de curba scăderii Ca2+. Disproteinemia serică, prin urmare, are efecte asupra metabolismului calciului – încă un argument pentru ca EPS să devină analiză medicală de rutină. Atunci când din CaT se ionizează o cantitate prea redusă, urmând ca prin aport să „vină” alte cantități de Ca în sânge, oganismul „organizează” evacuarea acestuia. Iar evacuarea se face fie prin oxalații de Ca - cu apariția de litiază renală -, fie prin calcificări la nivelul unor organe, ori prin apariția osteofitelor. Microcalcificările care pot să apară la nivelul diverselor tumori – inclusiv mamare –, sunt o „abatere” de la regula normală a raportului ALB – Ca2+: valorile procentuale ale ALB în cadrul EPS continuă să scadă, în chimb valorile Ca2+ cresc, oricare ar fi valorile CaT. Teoria ne aparține. Se întemeiază pe studiul comparativ al documentelor cazurilor clinice din baza de date a Apitherapy Medical Center, putând deveni un marker al evoluției înspre cancere sau al recidivelor acestora.
5.În unele cazuri, cantități de lichid pot rămîne neresorbite și în ductele galactofore, îndeosebi în zonele apropiate mamelonului. Locul se îngroașă, având la palpare tot aspectul unui nodul – este un așa-numit papilom intraductal. Astfel de acumulări de lichid în ductele mamare pot să apară și în lactația normală, atunci când sunt probleme legate de supt, de mulgere, de lapte mamar insuficient evacuat. Rămânând în ducte, dau naștere la așa-numitele papiloame intraductale. Se pot manifesta prin inflamații, scurgeri mamelonare de diferite culori etc., ori pot fi precursoare ale așa-numitelor tumori phyllodes (cystosarcoma phyllodes). Cancerizează mai rar decât fibroadenoamele, dar dacă au această evoluție, stroma celulară progresează mai repede, tumorile cresc la dimensiuni mai mari, sunt invazive și, se pare, progresia lor este „sprijinită” și de structura grăsoasă a sânilor. Lipidemia crescută și dislipidemia favorizează tumorigeneza.
6.Cortizolul este cel mai important hormon glucocorticoid. Este sintetizat de către corticosuprarenale sub influența ACTH (hormonul adrenocorticotrop) secretat de către adenohipofiză dintr-un precursor comun cu PRG: colesterol-pregnenolon. Pregnenolonul este transformat în androgenizantul 17-hidroxiprogesteron (17-OHP), cu creșterea PRG, inducînd și creșterea PRL. Corizolul circulă sanguin legat de CBG (proteina de legare a corticosteroizilor – corticosteroid binding globulin) și de ALB în proporție de 90%. Are funcții antiinflamatorii și imunosupresoare atunci când este în valori normale. Atuncicând crește peste v.n., din protector și reglator al multor funcții normale ale organismului, devine un „agresor”: dereglează funcțiile imunității normale, crește colesterolul și obezitatea, conduce la anxietate, depresii, insomnii etc. Creșterea cortizolului poate fi stimulată și prin administrarea de estrogeni, contraceptive, ca răspuns la creșterea anticorpilor care pot deveni autoanticorpi (globulina γ crește înspre- sau peste limita maximă a v.n.) etc.
7.Fibrozările de organ - mamară în acest caz - sunt leziuni autoimune.
8.Glucoza în valori normale, fapt mai puțin știut, are un rol important - alături de alte substanțe apicole – în formarea endometrului normal.
9. Pneumonia interstițială nu este deloc idiopatică (din cauze necunoscute, criptogene). Anterior debutului, are loc o anumită proliferare a fibrozării interstițiilor pulmonare. În stadii mai avansate, se pune diagnosticul de fibroză pulmonară idiopatică. Diagnosticul este de regulă clinic și de excludere a altor cauze ale pneumoniei, iar uneori se diagnostichează prin biopsie pulmonară deschisă, sau prin toracoscopie. Este lipsit de sens să indicăm vreo bibliografie privind așa-zisa criptogenie a pneumoniei interstițiale, pentru că prezintă unanimitate! Se admite și o posibilă cauză autozomal dominantă - familială – transmisă cromozomial. Nu negăm unele cazuri, foarte rare, de transmitere autozomală a fibrozării pulmonare interstițiale. În cvasitotalitatea cazurilor, fibroza pulmonară poate fi materno-fetală, poate fi urmarea moșteirii unei predispoziții dobândită congenital, sau se poate datora unor disproteinemii dobândite. Întotdeauna are caracteristici autoimune.Toate aceste „anomalii” diagnostice sunt curente, iar cauza lor este neînțelegerea caracterului autoimun al fibrozării pulmonare. La copii,tineri și adulți autoimunitatea este patologică, în timp ce fibroza pulmonară la vârstnici este cauzată de autoimunitatea fiziologică: instalarea autoimunității cu fibrozarea sistemică este normală senectuții și progresează lent, în măsura în care sinteza de ALB scade procentual, corespunzător cu creșterea sintezei globulinelor fibroproteine și a imunoglobulinei γ. Pneumonia interstițială poate fi însoțită și de alte fibrozări (cea mamară în cazul fiicei), cea uterină, mamară și pulmonară în cazul mamei, care face astm. Analizele pe care le recomandăm spre a deveni analize de laborator de rutină – PT, EPS și Ca2+ -, ar putea orienta diagnosticianul înspre cauzele autoimune ale fibrozărilor, deci și înspre diagnosticarea corectă a pneumoniei interstițiale autoimune. De asemenea, biologia moleculară și imunologia ar trebui să aibă o pondere crescută între studiile studenților mediciniști. De asemenea, a diagnostica afecțiunile autoimune ale copiilor și tinerilor, fără a le raporta la AHC materne mai ales, dar și paterne, este o practică clinică deficitară. Studiile medicale indică terapia pneumoniei interstițiale, oricare ar fi nivelul fibrozei, prin corticoterapie, dar „se plînge” că înregistrează ameliorări – nu vindecări - în numai circa 20% din cazuri. Insuccesele nu pot fi decât perfect explicabile. Corticoterapicele – oricare ar fi denumirea lor farmaceutică comercială -, obișnuit scad ALB și Ca2+. Cu atît mai mult vor face acest lucru în cazurile hipercotizolemiei androgenizante, dobândită fie materno-fetal, fie din orice alte cauze.
10.Stresată de sânii prea mici și din dorința unei alte talii, exact în timpul absenței menstrelor, fata renunță la alimentația obișnuită în familie și consumă mai ales tot felul de semințe despre care se informează pe internet. Într-adevăr, greutatea corporală scade, în schimb nivelul lipidelor totale (LT) crește alarmant, iar COL depășește nivelul maxim al v.n. În felul acesta, prost „consiliată” de calculator, scade nivelul grăsimii straturilor adipoase (celulele adipoase au un rol în estrogenemia normală). Această alimentație greșită, ajută acțiunea hiperlipemiantă a cortizolului crescut.


