
Cancer mamar ante menopauză – 35 ani/ 1,70 m/ 59 kg
Așa cum subliniază literatura medicală din domeniul cancerelor mamare, marea majoritate a acestora se datorează cancerizării fibroadenoamelor mamare și debutează mai ales după intrarea în menopauză. Un scurt istoric al evoluției stării de sănătate a pacientei, în acest caz, poate fi ilustrativ pentru debutul unui cancer mamar ante menopauză.
Născută cu rahitism - fapt care demonstrează o hipocalcemie maternă în sarcină –, de către mamă care a făcut cancer mamar la 43 de ani și a mai trăit până la 46 de ani. Am putea presupune, că fiica – al cărui caz îl punem în discuție aici -, a făcut un cancer mamar cu determinare genetică, deci cu posibila implicare a genelor BRCA1 și BRCA2.
Ca antecedente patologice personale (APP), fiica prezintă semnele și simptomatologia unei predispoziții androgenizante congenitale (vezi Cazul 5. Fibroadenoame mamare). Face o androgenizare hormonală prepubertară, cu acnee și păr seboreic. Menarha apare la 16 ani și numai prin hormonoterapie. A avut menstre foarte dureroase, neregulate, cele hipomenoreice alternează cu cele hipermenoreice, cu tensionarea sânilor antemenstrual, semn al unei PRL prea crescute.
Pentru acestea a făcut unele tratamente hormonale, care au accentuat androgenizarea hormonală congenitală. La vârsta de 32 de ani a fost diagnosticată, la sânul stâng, cu un nodul mamar deja vascularizat, cu dimensiunile de 9/11 mm, care a fost îndepărtat chirurgical. Ecografia mamară făcută acum, consemnează faptul că sânii au o structură intens fibro-glandulară.
Diagnosticată cu cancer mamar în urma examinării histopatologice al fibroadenomului extirpat chirurgical, a făcut chimioterapie și radioterapie, inducându-i-se și menopauza pentru șase luni, urmare a numărului crescut al receptorilor pentru estrogeni ai tumorii. Hiperestrogenemia însă, urmărind evoluția sa hormonală, nu se justifică: manifestările sunt cele ale unei tinere cu status hormonal androgenizant.
După un an de la operație, a fost diagnosticată cu metastaze osoase „de diferite mărimi și intensivități” la nivelul întregului schelet, inclusiv cranian. Fibroadenomul mamar a fost exclus chirurgical după ce deja organismul „construise” căile de evadare a celulelor canceroase. Aceste căi sunt microvasele sanguine de neoangiogeneză, care infiltraseră deja fibroadenomul.
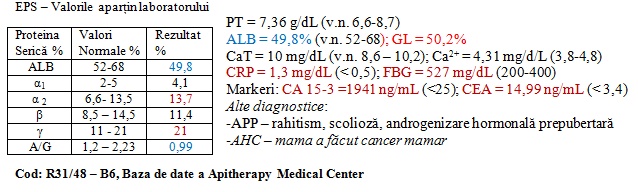
Nu s-a făcut nici o investigație privind posibilitatea unui cancer cu predispoziție genetică, fiind fiica unei mame care a făcut cancer mamar. Specialiștii afirmă: pentru ca fiica să facă un cancer mamar cu determinare genetică, genele care predispun la cancer trebuie să-i fie transmise de către ambii părinți. Chiar dacă ar fi fost demonstrată cauzalitatea genetică, boala canceroasă a pacientei, abordată ca disproteinemie, urmează „tipicul” obișnuit în cancerele mamare: scăderea procentuală a ALB în EPS, simultan creșterii nivelului procentual al GL (mai ales a imunoglobulinei γ), însoțită de creșterea CaT și Ca2+. Aceste evoluții se produc pe fondul unei prolactinemii constant crescute antemenstrual.
Revenim asupra afirmației: cancerul mamar este una dintre cele mai evitabile, mai profilactice afecțiuni feminine:
-profilaxia cea mai eficientă este reechilibrarea PT prin reechilibrarea PS1 a femeii care decide să aibă o sarcină prin:
- asigurarea unui raport normal al proporțiilor procentuale ale ALB și GL astfel încît, în cadrul raportului A/G al PS, ALB să aibă valori peste 60%, iar GL să fie sub 40% (fiecare globulină –α1, α2, β și γ trebuind să fie în zona jumătății2 dintre limitele minim-maxim ale v.n.);
-ALB în v.n. corespunde ionizării în valori fiziologice a Ca, cu evitarea efectelor hipocalcemiei materne asupra fătului;
-imunoglobulina γ în v.n. în sarcină, nu determină creșterea cortizolemiei materne care, asupra fiicelor, are efecte androgenizante (vezi evoluția hormonală a fiicei în Cazul 5, Fibroadenoame mamare); aici ne aflăm pe terenul unor presupuneri care, dacă nu sunt confirmate prin cercetări fundamentale și clinice, cel puțin corespund – credem - logicii imunologiei clinice2;
-profilaxia încă eficientă, constă în echilibrarea PT, PS, Ca2+ și hormonală (cu normalizarea cortizolului, ESTR, PRG și PRL) a fetelor înainte sau imediat după debutul menstrelor:
-nivelurile normale ale EPS (ALB, GL) și ale Ca2+, exclud fibrozarea mamară precursoare a apariției fibroadenoamelor (ca regulă, în fibrozări, globulina γ crește la- sau și peste limita superioară a v.n.;
-nivelele normale ale PRL (prin normalizarea ESTR și PRG), exclud tensionarea antemenstruală anormală a sânilor, deci exclud necesitatea intervenției fibroproteinelor pentru a forma noduli fibroși (izolatori) în jurul posibilelor cantități de lichid rămase în lobuli;
-ecografic sau prin alte tehnici imagistice, medicul va estima nivelul fibrozării sânilor și stadiul în care se află posibilele fibroadenoame;
-ca analize de laborator, oricare altele s-ar face în timpul fibrozării sânilor, în cel al apariției și în cel al stadiului benign al fibroadenoamelor, ALB și Ca2+scad sincronînspre minima v.n. și chiar sub acestea; oprirea acestei scăderi și măsurile terapeutice pentru restabilirea v.n. ale acestora, constituie cea mai eficientă profilaxie a debutului cancerizării fibroadenoamelor;
-dincolo de orice alte analize și investigații, evoluția predictivă înspre cancerizarea fibroadenoamelor și însăși cancerizarea, pot fi suspicionate prin evoluția cantitativă diferită a valorilor ALB – care scade continuu -, în timp ce valoarea Ca2+ crește continuu, oricare ar fi valoarea CaT3;
-profilaxia metastazării fibroadenoamelor mamare cancerizate, prin analize de laborator și imagistic:
-atunci când valoarea procentuală a ALB scade sub un anume nivel, se activează factorii angiogenici, care conduc la apariția, pe vasele de sânge existente, mai întâi a unor muguri vasculari, observabili ecografic; acești muguri vasculari încep să „crească” înspre fibroadenomul cancerizat pentru a-l infiltra, creând căile migrării celulelor tumorale care vor sta la baza apariției unor alte tumori (diseminări secundare, metastaze);
-normalizarea valorilor procentuale ale ALB în cadrul EPS, va interzice activitatea factorilor angiogenici și va reduce la normal excesul de proteine globuline care intră în structura celulelor specifice endoteliului (peretelui) vascular al vaselor de neoformare; în unele cazuri, vasele de neovascularizare se resorb; în alte cazuri lumenul lor se reduce într-atât, încât nu mai permite circulația sanguină înspre și dinsprefibroadenomul cancerizat4;
-dacă supravegherea ecografică a fibroadenomului este corectă, intervenția chirurgicală pentru îndepărtatrea fibroadenomului cancerizat este bine să se facă înainte ca vasele nou formate să ajungă perinodular și, cu atât mai mult, înainte ca aceste neovase să infiltreze fibroadenomul.
În cazul de față, nu s-a luat nici o măsură profilactică. Formarea fibroadenomului, cancerizarea și vascularizarea sa au avut loc insidios, fără nici un fel de semne și simptome. Excluderea chirurgicală după vascularizare, a făcut posibilă metastazarea despre care am vorbit.
Ar putea fi studiată și posibilitatea ca, prin creșterea ALB și scăderea GL, să se obțină resorbția neovaselor sanguine care mijlocesc metastazarea. Desigur, opțiunea intervenției aparține medicului specialist.
Ar fi necesare studii care să raportreze evoluția hormonală (cortizol, ESTR, PRG și PRL), la evoluția valorilor EPS și Ca în cancerizarea mamară și în metastazare. Atunci când timpul ne va îngădui, analizând clinic un număr relevant de cancere mamare, concluziile la care vom ajunge vor avea un alt nivel de fermitate.
__________________________
1.Dacă, așa cum propunem, EPS și Ca2+ ar deveni analize de laborator de rutină, reechilibrând PT prin reechilibrarea PS, profilaxia s-ar putea aplica unui număr impresionant de boli înainte de debutul acestora. Aceste analize însă, ar trebui să devină uzuale măcar atunci când ambii tinerii care se pregătesc să devină părinți. Dacă mama are un rol crescut în sănătatea descendenților, nici rolul tatălui nu poate fi neglijat (la locul potrivit, vom prezenta și un caz de imunosupresie transmisă patern celor doi copii ai familiei).
2.Prin „zona jumătății” față de limitele minim-maxim ale v.n. ale analizelor de laborator, înțelegem ca valoarea analizei să nu fie nici prea apropiată nici de minima v.n, nici de maxima v.n. Spre exemplu, la v.n. ale hemoglobinei (HGB) de 12-17 g/dL, este bine ca valoarea determinată să fie în preajma valorii de 14,5 g/dL. Dacă aceasta scade sub 13 g/dL, cu cât se apropie mai mult de 12 g/dL, cu atât se poate suspiciona o evoluție înspre anemie. Dacă dimpotrivă, valoarea crește lângă 17 g/dL, se poate intui o evoluție înspre poliglobulie. Evident, dacă HGB are valoarea de 12,1g/Dl – deci la limita „căderii” în anemie, în mod normal laboratorul nu o va încadra în „chenarul de atenționare”, pentru că se încadrează în limitele minim-maxim ale v.n. Clinicianul însă, interpretând valoarea determinată a HGB în context clinic, va decide dacă va lua ori nu măsuri profilactice pentru oprirea evoluției înspre anemie. Spre exemplu, dacă ALB în cadrul EPS are valoarea procentuală de minim 60% și dacă GL sunt în v.n. atât cantitativ (valoarea lor totală nu depășește 40%), cât și structural (fiecare GL are valori procentuale normale), bolile sunt o raritate. La o valoare procentuală a ALB de peste 63% (63-66%), dacă și GL au v.n., bolile – oricare ar fi acestea -, sunt cu totul excepționale, inclusiv cele autoimune. La astfel de valori, inclusiv în cazul infecțiilor cu oricare virus, organismul își mobilizează toți factorii de apărare înnăscuți, inclusiv interferonii proprii și negativează virusul fără ca, în cele mai multe cazuri, individul să știe că a fost infectat. De regulă studiile medicale nu atrag atenția asupra hiperalbuminemiei procentuale în cadrul PS. Dacă ALB mamei în sarcină depășește limita superioară a v.n., există posibilitatea ca organismul matern să nu poată produce și, deci, să nu poată „trimite” fătului, prin sângele placentar, o cantitate normală de celule de endoteliu vascular sau/și de fibroblaști, necesare osteogenezei normale, conducând spre rara, dar grava boală a „oaselor de sticlă” (sistemul osos al fătului este lipsit de vascularizarea normală, ca și de osteoblaștii care asigură structura, creșterea și elasticitatea normală a oaselor. Teoria cauzei acestei boli ne aparține, nu am tratat nici un caz de boală a oaselor de sticlă, dar avem convingerea că, imunologic, este reală. Prin urmare, această boală nu are cauze idiopatice, așa cum se spune în toate studiile medicale care i se dedică. În schimb, am tratat cu succes două cazuri de ihtioză, boală considerată tot idiopatică, dar explicabilă dacă se alătură și se compară EPS a mamei și a copilului bolnav. Hiperalbuminemia maternă a corespuns sintezei foarte reduse a fibroproteinelor, care au rolul de a oferi elasticitatea și creșterea normală a pielii copilului. Dimpotrivă, hipoalbuminemia maternă, cu creșterea imunoglobulinei γ înspre- sau peste limita maximă a v.n., poate conduce la unele boli ale fătului chiar în viața intrauterină, sau „îi transmit” predispoziții precursoare a multor dezechilibre ale PT și a multor afecțiuni: înspre hipoalbuminemie, înspre sinteza unui enui exces de fibroproteine, înspre artrita juvenilă – care nu este deloc idiopatică -, înspre multe boli ale țesutului conjunctiv, înspre androgenizarea hormonală etc. etc. Am mai spus astfel de lucruri. Le vom mai spune, cu intenția precisă de a conștientiza importanța EPS și a Ca2+ în sănătatea umană (importanță condiționată de efectuarea acestor analize, de cunoștințele din domeniul imunologiei ale clinicianului diagnostician, dar și pentru profilaxia predispozițiilor dobândite materno-fetal).
3.Este posibil ca nivelul ionizării Ca să nu aibă vreo influență directă în neovascularizare. Observațiile clinice ne-au condus la ideea că, spre exemplu, în neovascularizarea care precede fibromatoza uterină, ALB scade simultan scăderii valorilor Ca2+, în timp ce în neovascularizarea care însoțește cancerele, valoarea ALB scade, în timp ce valoarea Ca2+ crește. Aceasta ar fi una dintre problemele în care cercetarea fundamentală în domeniul biologiei celulare și moleculare ar trebui să „afle” molecula/moleculele, proteina/proteinele care determină creșterea ionizării Ca chiar și în condițiile în care CaT circulant sanguin se află sub minima v.n. Dacă valorile ALB și Ca2+ sunt normale atunci când organismul are starea de imunitate, dacă valorile lor cresc ori scad sincron în orice altă afecțiune, iar în cancere „drumurile” lor se despart, când începe și ce anume determină această „despletire” de drumuri? Precede cumva transformarea canceroasă a primei celule care „inițiază” tumorigeneza malignă, „prevestind” debutul cancerelor? Începe după debutul cancerizării? Calcificările intratumorale au sau nu aceleași cauze care conduc la calcificările care apar și în afara diagnosticului de cancer? Restabilirea „drumului” creșterii sau scăderii sincron a ALB și Ca2+ ar putea contribui la remisia bolilor canceroase? Credem că cercetarea fundamentală din domeniul științelor medicale, ar trebui să se sincronizeze cu cercetarea clinică și cu problemele reale care stau în fața clinicianului. Sunt cercetători care jumătate din viață caută o moleculă, iar cealaltă jumătate stau cu barba în pumn, încercând să-și dea seama ce utilitate ar putea avea descoperirea lor. Normal ar fi ca cercetarea clinică să pună probleme cercetării fundamentale, iar aceasta să-i ofere răspunsurile de care are nevoie clinicianul la patul pacientului. Rezultatele reale ale cercetării științifice, în definitiv, nu au menirea satisfacerii orgoliilor, ci sunt destinate binelui pacientului.
4. Ar fi bine ca, restabilind albuminemia fiziologică, să se prevină debutul neoangiogenezei. Noi avem convingerea că ALB - în v.n. -, este un antiangiogenic superior tuturor medicamentelor antiangiogenice actuale și viitoare la un loc. Nu știm dacă antiangiogenicele interferează cumva funcțiile fiziologice ale ALB sau chiar pot contribui în vreun fel la reducerea în continuare a valorii procentuale a ALB în cadrul EPS. Această problemă nu este discutată nici în literatura medicală, nici în prospectele medicamentelor antiangiogenice. Știm și putem argumenta cu cazuri clinice din domeniul fibroamelor uterine că, apiterpeutic, crescând nivelele procentuale ale ALB în cadrul EPS, realizăm pe o altă cale ceea ce în practica clinică curentă se numește embolizarea fibromului uterin. Embolizarea își propune să blocheze afluirea fibroproteinelor înspre fibrom, pe această cale interzicând creșterea acestuia. Dacă în unele cazuri reușește, embolizarea nu normalizează nici sinteza ALB, nici pe cea a proteinelor GL fibroproteine, nici ionizarea Ca. Disproteinemia care a cauzat apariția fibromului nu este modificată. Dimpotrivă, embolizarea „apicolă” interzice creșterea fibroamelor prin restabilirea nivelelor ALB, GL și Ca2+, astfel încât nu mai există un surplus de fibroproteine care trebuie „scoase” din sânge și „depozitate” în fibrom. Pe de altă parte, prin creșterea ALB, are loc fie resorbirea microvaselor de neoformare, fie îngustarea lumenului lor, astfel încât nu mai este practicabil, fie au loc ambele procese.
Dacă la fel se întâmplă și în neovascularizările care se produc în cancerizarea fibroadenoamelor mamare, ar putea fi luat în considerație momentul cel mai lipsit de riscul metastazării în care se face intervenția chirurgicală. Pentru aceasta însă, trebuie luat în considerație faptul că intervenția de extirpare nu s-a făcut înainte ca neovasele să infiltreze fibroadenomul, când riscurile recidivei și metastazării sunt foarte reduse. Literatura de specialitate cu referire la cancerele mamare dormante, raportează cazuri de deces ale femeilor care au de mulți ani un cancer mamar in situ, dar care au încetat din viață din cu totul alte cauze, inclusiv prin îmbătrânirea fiziologică. În aceste situații neovascularizarea și „conectarea” fibroadenomului cancerizat nu s-a produs, iar cancerizarea a fost insidioasă, fără semne și simptome și după aceea. Pe de altă parte, se poate lua în considerație faptul că există un timp între infiltrarea vasculară a fibroadenomului și momentul în care primele celule canceroase migrează pe această cale. Rolul primar al neovascularizării nu este metastazarea, ci „hrănirea” tumorii. Ideal ar fi ca acum, în acest stadiu, să se poată face antiangiogeneza care ar putea conduce la resorbția microvaselor neoformate sau diminuarea lumenului lor astfel încât să se interzică circulația înspre și dinspre tumoră. Atunci, într-o astfel de situație, intervenția chirurgicală ar putea evita metastazarea. Este foarte greu, spre imposibil chiar, să se știe dacă migrarea celulelor canceroase a început înainte de intervenția antiangiogenică, admițând că aceasta ar fi un succes. Apariția tumorile diseminate (metastazele) nu coincid instant începutului migrării celulelor canceroase. Unele - sau și toate -, pot fi ucise atunci când se află în „șuvoiul” circuitului sanguin prin intervenția factorilor antitumorali ai sistemului imun al organismului. Sau - și prin intervenția eficace a medicației antutumorale. Altele – cele care se fixează într-o zonă favorabilă cancerizării – pot rămâne inactive un anumit timp. Extirparea chirurgicală a tumorii primare (fibroadenomului cancerizat), nu mai are nici o influență asupra metastazei/metastazelor. Acestea vor evolua independent.


